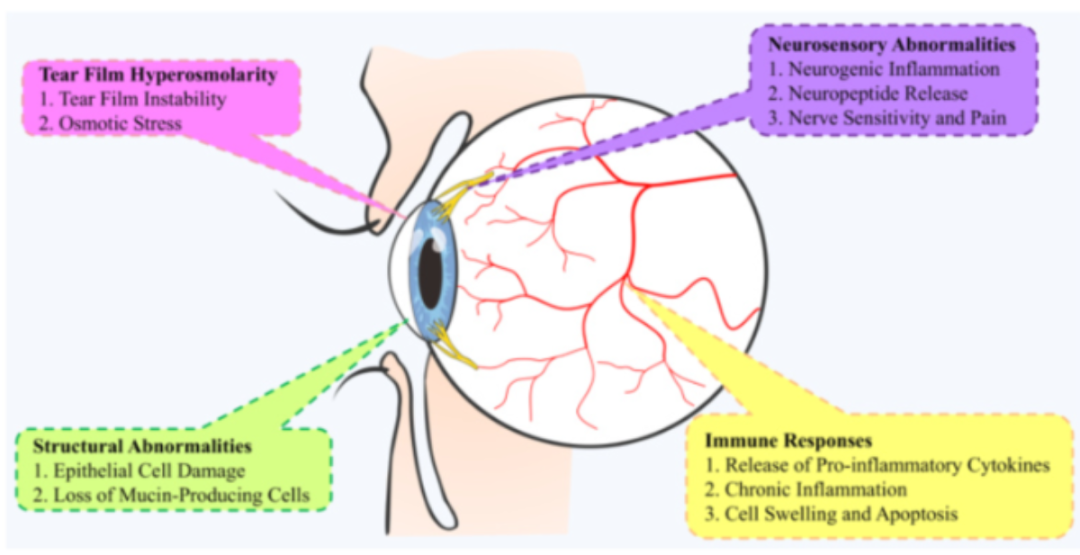
干眼症(Dry Eye Disease, DED)是全球高发眼表疾病,近年来,由于电子设备的普及,长时间使用电脑、手机和平板等设备导致眨眼频率减少,泪液蒸发过快,干眼症的患病人群呈现出低龄化趋势,尤其是在儿童和青少年中。在中国,干眼症的患病率较高,约为21%至30%,这意味着中国有近3亿人受到干眼症的影响。
干眼症的主要病理原因为泪液层稳定性的降低和眼睑与眼球之间的摩擦力增加导致的眼干、眼痛、眼表炎症。根据病因和病理,干眼症可以分为两种主要类型:缺水性干眼和蒸发性干眼,缺水性干眼是由泪腺功能障碍引起的泪液分泌减少所致,而蒸发性干眼则是由于睑板腺功能障碍或脂质层异常导致的过度泪液蒸发。
传统干眼症疗法如人工泪液仅能暂时润滑眼表,抗炎药环孢素需数周起效,严重患者甚至需手术干预。这些方法难以解决泪液分泌不足的根本问题,且长期使用存在耐药性及副作用风险。近年来,随着对干眼症机制的深入研究,一些新型治疗方法也在探索中,为患者提供了更多治疗选择,本次要和大家分享的是与角膜感觉神经相关的干眼症治疗方向-TRPM8受体激动剂。
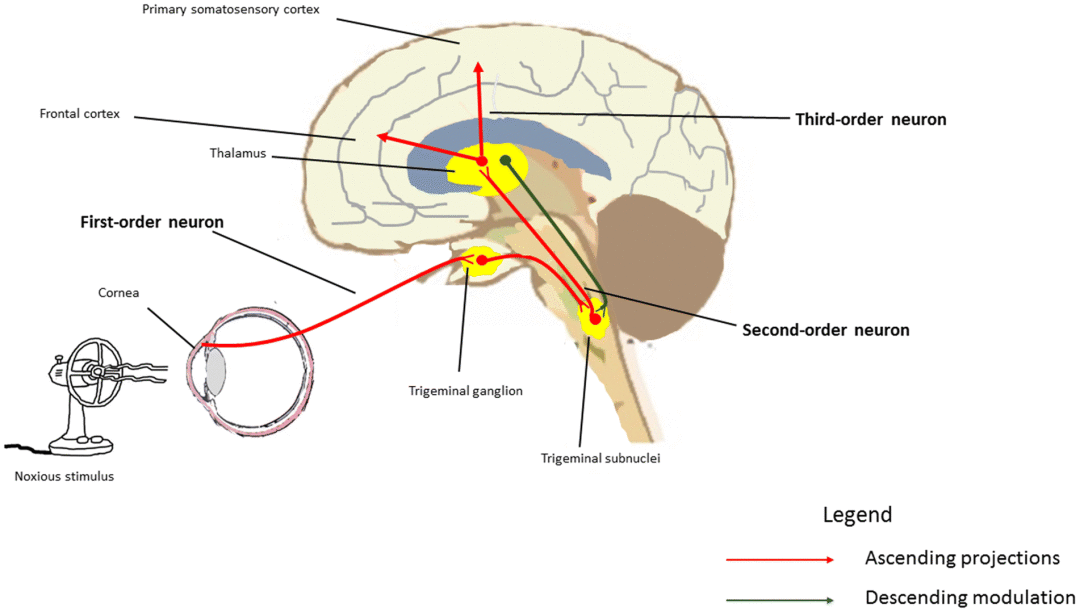
角膜中密集分布着神经纤维,角膜神经从角膜实质进入,延伸至上皮层表面,接收来自眼表面的各种信息,对维持眼表面的稳定性发挥重要作用。此外,这些神经纤维大多为支配角膜感知的三叉神经第一支眼支的纤维,根据其表达的受体和功能的不同,分为三种类型。
表达机械刺激感受器(离子通道)Piezo2的机械感受神经,据称它参与了眼表触觉、压觉或摩擦引起的疼痛等。
在疼痛感知中发挥重要作用的感受器,其神经末梢表达由辣椒素中的辛辣成分辣椒素、酸或热激活的TRP(瞬时受体电位)TRPV1 和由芥末中的辛辣成分烯丙基异硫氰酸酯或肉桂碱激活的TRPA1 等离子通道,能够感知各种侵害刺激。
表达冷感受器的冷感受神经,该神经表达感知温度下降和渗透压升高的离子通道TRPM8。这种神经在保持睁眼状态时,通过泪液蒸发带走的气化热量导致的眼表温度下降和泪液蒸发伴随的泪液渗透压升高来感知,并向中枢传递眼表干燥状态的信息,分为低阈值和高阈值两种。低阈值的神经不仅传达冷感,还通过上述反射性泪液分泌系统引发泪液分泌,另一方面,高阈值的神经被认为与干涩感及其相关疼痛有关。
表达分布:TRPM8在眼部组织中主要表达于初级感觉神经元和其周围神经末梢,特别是在角膜上皮细胞、视网膜神经节细胞和小胶质细胞中。TRPM8在角膜上皮细胞中也存在,但其表达水平可能因细胞类型和培养条件而异。此外,TRPM8在视网膜内层(如神经节细胞层和内核层)也有表达。TRPM8还通过与薄荷醇和伊西林等化学配体结合,参与冷感和薄荷感的传导。
功能作用:TRPM8在眼部的主要功能是作为冷觉感知的主要受体,参与调节泪液分泌和角膜湿润度。TRPM8激活可引起膜电位去极化,导致动作电位的产生,从而引发冷感和薄荷感。TRPM8还参与调节角膜表面的湿润度,通过影响眨眼频率和泪液分泌,与干眼症的发生密切相关。此外,TRPM8在视网膜神经节细胞中可能参与昼夜节律的调节,通过与下丘脑视交叉上核(SCN)的连接,影响核心体温的调节。在角膜修复过程中,TRPM8的表达可能影响上皮细胞的修复速度和分化状态。
泪液分泌的神经调控:
冷觉-泪液反射弧:近年来的研究表明,表达TRPM8的神经特别与维持眼表的稳定性密切相关,每次眨眼时,泪液都会形成泪液层并扩展到角膜和结膜表面,但当保持睁眼状态时,由于泪液层水分蒸发导致泪液层变薄,最终可能产生破坏。随着泪液层的破坏,该部位角膜表面的温度下降1-2°C,激活TRPM8阳性冷感受神经元,角膜冷感受神经的终末部中的TRPM8感知到这一点,通过三叉神经-脑干-副交感神经通路,刺激泪腺分泌泪液,增加泪液层厚度,恢复泪液层的稳定性,从而维持眼表的稳定性。
渗透压感知:由于保持睁眼状态引起的泪液层破坏会引发泪液渗透压的升高,TRPM8感知到这一点后,促使眨眼动作,使泪液层重新形成。此外,这一机制同样有助于恢复泪液层的稳定性,甚至维持眼表的稳定性。
神经感觉异常的调节:
干眼症患者常伴神经性疼痛和感觉过敏。TRPM8与痛觉标记物TRPV1在50%的感觉神经元中共表达,其激动剂可选择性激活冷觉通路,避免触发TRPV1介导的痛觉信号,从而缓解疼痛性干眼症状。
炎症恶性循环的干预:
泪液高渗透压激活眼表炎症通路(如NF-κB),释放IL-1β、TNF-α等促炎因子。TRPM8激动剂通过增加泪液分泌、稀释渗透压,间接抑制炎症级联反应
TRPM8(瞬时受体电位M8通道)作为冷觉感受器,在角膜感觉神经元中高表达,近年来被视为潜在治疗靶点。目前所有进入临床的TRPM8靶向药物均为激动剂,旨在通过增强冷觉信号反射性增加泪液分泌,但仍存在一些潜在风险和临床应用挑战。
1.副作用与安全性问题:
温度感知异常:某类TRPM8拮抗剂在临床试验中因诱发面部/肢体灼热感、感觉异常等副作用而终止。激动剂虽无此类报道,但长期使用可能导致冷适应障碍。
2.机制争议与治疗矛盾:
激动 vs 拮抗的悖论:TRPM8激动剂可增强泪液分泌,适用于泪液分泌不足型干眼,TRPM8拮抗剂可减轻神经炎症和疼痛,适用于神经痛型干眼。但DEWS II(2017)强调,干眼患者中神经调节异常是重要病因,干眼引起的慢性炎症和泪膜高渗状态可直接损伤角膜神经,诱发神经病理性改变,因此干眼症患者神经疼痛与泪液分泌不足常共同存在。TRPM8激活在早期可增加保护性泪液分泌,但慢性过度激活可能促进炎症因子(如IL-6、TNF-α)释放,加重眼表损伤。因此对同一靶点具有双向调节需求的干眼患者存在治疗矛盾,需根据干眼亚型个体化用药。
3.应用局限与未解决问题:
亚型选择局限:TRPM8激动剂对蒸发过强型干眼(如睑板腺功能障碍)效果有限,需联合抗炎或脂质替代治疗。
长期疗效未知:尚无数据证实TRPM8激动剂能否逆转神经感觉异常或泪腺纤维化等慢性病变。
药物耐受性风险:反复激活TRPM8可能导致受体脱敏,降低治疗效果。
TRPM8靶向治疗是干眼症领域的突破性进展,尤其在泪液分泌促进方面已获临床验证,通过激活角膜TRPM8受体,可以调节自然泪液分泌,在增加泪液分泌、快速缓解干眼症状方面具有明确优势,但仅适用于泪液分泌不足型干眼。由于TRPM8受体还参与痛觉的表达,对于神经痛型干眼患者来说,TRPM8受体激动剂有可能会进一步加重神经炎症和疼痛,存在同一靶点双向需求的治疗矛盾。未来须明确TRPM8在干眼亚型中的动态表达变化,通过分型精准治疗、新型药物设计和联合策略,最大化获益并规避风险。
参考文献:
Fakih D, Baudouin C, Réaux-Le Goazigo A, Mélik Parsadaniantz S. TRPM8: A Therapeutic Target for Neuroinflammatory Symptoms Induced by Severe Dry Eye Disease. Int J Mol Sci. 2020 Nov 19;21(22):8756.
Huang D, Li Z. Multidimensional immunotherapy for dry eye disease: current status and future directions. Front Ophthalmol (Lausanne). 2024 Nov 1;4:1449283.
Giorgia Chinigò. TRP channels functional role in prostate cancer angiogenesis and invasion. Cancer. Université de Lille; Università degli studi (Turin, Italie), 2022. English. ⟨NNT : 2022ULILS103⟩. ⟨tel-04196059⟩
Pérez de Vega MJ, Gómez-Monterrey I, Ferrer-Montiel A, González-Muñiz R. Transient Receptor Potential Melastatin 8 Channel (TRPM8) Modulation: Cool Entryway for Treating Pain and Cancer. J Med Chem. 2016 Nov 23;59(22):10006-10029.